Mechanoresponsive Moleküle als Bausteine für intelligente Materialien
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für Kolloid- und Grenzflächenforschung
Intelligente Materialien besitzen die Eigenschaft, einen externen Stimulus selbstständig in eine definierte Antwort umzuwandeln. Bisher existieren nur wenige Materialien, die eine mechanische Schädigung durch eine Änderung ihrer optischen Merkmale sichtbar machen oder Defekte selbst heilen können. Um diese Eigenschaften zu realisieren, sind mechanoresponsive Moleküle notwendig, die gezielt auf eine angelegte Kraft reagieren. Ziel der Forschung ist es, derartige Moleküle zu entwickeln, ihre Mechanismen zu verstehen und sie gezielt für die Entwicklung intelligenter Materialien einzusetzen.
Intelligente, mechanoresponsive Materialien
Intelligente Materialien können gezielt auf Änderungen ihrer Umgebungsbedingungen reagieren (siehe Abb. 1). Aus diesem Grund finden sie zunehmend Anwendung in verschiedenen Bereichen, von der Raumfahrt bis zur regenerativen Medizin. Die Max-Planck-Forschungsgruppe Mechano(bio)chemie am Max-Planck-Institut für Kolloid- und Grenzflächenforschung beschäftigt sich in erster Linie mit mechanoresponsiven Materialien. Diese reagieren mit einer spezifischen Antwort auf einen mechanischen Stimulus, wie etwa eine von außen angelegte Scher- oder Dehnkraft. Dabei kann die angelegte Kraft zu einer lokalen Änderung der optischen Eigenschaften führen oder auch chemisch reaktive Gruppen freisetzen.
Mithilfe mechanoresponsiver Materialen lassen sich wichtige Fragen in der materialwissenschaftlichen Grundlagenforschung beantworten und zugleich eine Reihe innovativer Anwendungen entwickeln:
- Untersuchung der Entstehung von Defekten und deren Ausbreitung im Material,
- Herstellung von Materialen, die entstehende Materialschäden frühzeitig anzeigen und/oder diese selbst heilen,
- Untersuchung der molekularen Mechanismen der mechanischen Zell-Material Wechselwirkung,
- Herstellung von synthetischen, biomimetischen Materialien, die die natürliche mechanische Umgebung von Zellen nachahmen und Zellfunktionen gezielt beeinflussen.
Um diese Ziele zu erreichen, werden Materialien und auch Methoden entwickelt, mit denen sich diese und andere mechanoresponsive Materialien sowie ihre molekularen Bausteine charakterisieren lassen.
Mechanoresponsive Molekülbausteine
Die Schlüsselkomponenten zur Herstellung von funktionalen Materialien mit diesen Anwendungsmöglichkeiten sind mechanoresponsive Molekülbausteine. Im Wesentlichen kann man dabei zwei komplementäre Funktionen dieser Bausteine unterscheiden. Sogenannte selbstheilende Bausteine besitzen eine Sollbruchstelle. Die entstanden Bruchstücke lassen sich in Abwesenheit einer Kraft F wieder zusammenfügen. Bei sogenannten defektkommunizierenden (engl. self-reporting) Bausteinen hingegen lässt sich ihr Zustand aufgrund einer vorprogrammierten Reaktion optisch detektieren (siehe Abb. 2).

Abb. 2: Mechanoresponsive Molekülbausteine zeigen eine definierte Reaktion auf eine von außen angelegte Kraft F. Selbstheilende Bausteine werden in Bruchstücke gespalten, die im Folgenden wieder miteinander reagieren können. Defektkommunizierende Bausteine sind in der Lage, ein optisch messbares Signal zu erzeugen, sobald die angelegte Kraft einen Grenzwert überschreitet.
Entsprechende Molekülbausteine können sehr unterschiedlich aufgebaut sein und sich auch bezüglich ihrer Anforderungen an die Umgebungsbedingungen unterscheiden. Chemiker haben verschiedene sogenannte niedermolekulare Mechanophore entwickelt, die häufig in Polymermaterialien wie etwa Polymethylmethacrylat eingebaut sind und mit denen sich dort mechanische Deformation oder Defekte aufspüren lassen [1].
Aber auch Biomoleküle werden als mechanoresponsive Molekülbausteine eingesetzt, um funktionale Hydrogele für Zellkultur-Anwendungen herzustellen. Mit vielen der bisher entwickelten Molekülbausteine lässt sich nur eine Aussage darüber treffen, ob überhaupt eine Kraft anliegt oder nicht. Die Max-Planck-Forschungsgruppe entwickelt hingegen Moleküle, die auch Information über die Stärke der maximal angelegten Kraft liefern können [2, 3]. Im Folgenden soll jeweils ein niedermolekularer Mechanophor (Beispiel 1) sowie ein biologischer Molekülbaustein (Beispiel 2) vorgestellt werden.
Beispiel 1 – Triazol Bausteine
Die Anzahl an Bausteinen, die sowohl selbstheilend als auch defektkommunizierend sind, ist bisher sehr begrenzt. Triazol-Ringe, wie sie in der Cycloaddition eines Azids (N3) mit einem Alkin entstehen, sind mögliche Kandidaten, die beide Funktionen verbinden (siehe Abb. 3). Ließe sich diese Cycloaddition durch eine anliegende Kraft umkehren (Cycloreversion), wären Triazol-Ringe ideale Materialvernetzer mit selbstheilenden Eigenschaften. Mechanisch freigesetzte Alkine können darüber hinaus mit einem fluorogenen Azid reagieren und so entstandene Defekte auf molekularer Ebene anzeigen [5].
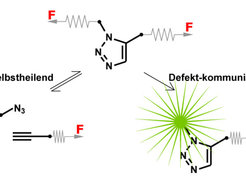
Eine mögliche mechanisch-induzierte Cycloreversion hat unsere Arbeitsgruppe in Computersimulationen untersucht und dabei sowohl verschiedene chemische Strukturen als auch verschiedene Kraftangriffspunkte getestet [6, 7]. Das in Abb. 3 gezeigte 1,5-Regioisomer entsteht in der Reaktion eines Azids mit einem terminalen Alkin in einer Ruthenium-katalysierten Reaktion. Die Simulationen zeigten die gewünschte Cycloreversion und bestätigten, dass Triazol-Ringe als mechanische Bausteine mit interessanten Eigenschaften dienen könnten. Um die selbstheilenden oder defektkommunizierenden Eigenschaften auszunutzen, wäre allerdings ein Katalysator notwendig.
Im Gegensatz zu terminalen Alkinen sind ringförmige Cyclooctine in der Lage, Triazole ohne den Zusatz eines Katalysators zu formen. Cyclooctin-Strukturen eignen sich daher grundsätzlich besser als Materialvernetzer. Daher wurden die Computersimulationen auch für eine Reihe von Cyclooctin-basierten Triazol-Strukturen durchgeführt [4, 6, 7]. Dabei zeigte auch Azadibenzylcyclooctin (DIBAC) die gewünschte Cycloreversion. DIBAC wird aktuell im Labor mit Einzelmolekül-Kraftspektroskopie untersucht, um die Computer-basierten Vorhersagen experimentell zu bestätigen.
Beispiel 2 – Peptid-basierte Bausteine
Für die Kraft-induzierte Cycloreversion eines Triazol-Rings benötigt man relativ hohe Kräfte (mehr als 500 Pikonewton), da bei dieser mechanochemischen Reaktion kovalente Bindungen aufgebrochen werden müssen. Für viele biologische Anwendungen werden jedoch auch Molekülbausteine benötigt, die bei niedrigeren Kräften (10 bis 200 Pikonewton) reagieren. Zu diesem Zweck entwickelt die Arbeitsgruppe eine Bibliothek von Peptid-basierten Bausteinen, die im gewünschten Kraftbereich reagieren. Das Design dieser Bausteine ist inspiriert durch natürlich vorkommende Coiled-Coil-Strukturen, die in biologischen Geweben mechanische Funktionen ausüben.
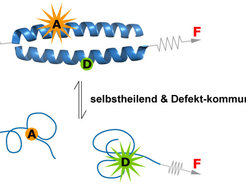
Abb. 4: Möglichkeiten der Verwendung von Coiled-Coil-formenden Peptiden als mechanoresponsive Molekülbausteine. Durch die angelegte Kraft entfaltet sich die helikale Struktur des Coiled-Coils, und es dissoziiert in seine Untereinheiten. Diese können in Abwesenheit der Kraft wieder aneinander binden und wiederum eine Coiled-Coil-Struktur ausbilden. Wird die Struktur zusätzlich mit einem Fluoreszenz-basierten Reportersystem ausgestattet, lässt sich der Zustand des Coiled-Coils optisch auslesen.
Coiled-Coil-Strukturen sind aus zwei oder mehr helikalen Peptidketten aufgebaut. Diese werden durch hydrophobe Wechselwirkungen sowie Ladungswechselwirkungen, zusammengehalten. Kurze Coiled-Coil-Sequenzen (bis etwa 35 Aminosäuren) lassen sich synthetisch herstellen [8]. Mittels Einzelmolekül-Kraftspektroskopie an solchen synthetischen Sequenzen versucht man derzeit, den Kraftaufwand zu ermitteln, der zur Trennung eines Coiled-Coil-Dimers notwendig ist (siehe Abb. 4). Bisher zeigte sich, dass sowohl die Länge als auch die Aminosäuresequenz (genauer die Stabilität der Helixstruktur) die dazu benötigte Kraft bestimmen.
Mit diesem Wissen werden aktuell verschiedene Sequenzen hergestellt, die bei Kräften zwischen 20 und 60 Pikonewton auseinanderbrechen. Diese mechanisch kalibrierten Molekülbausteine lassen sich nun als Materialvernetzer bei der Synthese von Hydrogelen verwenden [9, 10]. Ausgestattet mit einem Fluoreszenz-basierten Reportersystem ist es zudem möglich, den molekularen Zustand jedes einzelnen Coiled-Coils in einem Material zu visualisieren (siehe Abb. 4). Mit den so erhaltenen Hydrogelen soll künftig untersucht werden, wie die mechanischen Eigenschaften der einzelnen Vernetzer die Eigenschaften des Materials bestimmen und wie Zellen mit einem solchen Material mechanisch interagieren. Langfristig können solche Materialien dazu dienen, um Zell-generierte Kräfte zu messen [3] oder um zelluläre Mechanotransduktions-Mechanismen gezielt zu beeinflussen.
Literaturhinweise
Chemical Science 5, 1680-1697 (2014).



