Chemische Synthese zum Entschlüsseln der biologischen Funktionen von Glykosylphosphatidylinositolen (GPIs)
Forschungsbericht (importiert) 2014 - Max-Planck-Institut für Kolloid- und Grenzflächenforschung
Diverse eukaryotische Proteine sind durch Glykosylphosphatidylinositole (GPIs) in der Zellmembran verankert und erfüllen unterschiedliche, essentielle biologische Funktionen. Bisher ist wenig über die Funktionen des GPI-Ankers bekannt. Mithilfe synthetischer Methoden ist es nun jedoch möglich, diese Moleküle in reiner Form herzustellen und Erkenntnisse über ihre biologischen Eigenschaften zu gewinnen. Synthetische GPIs ermöglichen eine Differentialdiagnose von akuter und latenter Toxoplasmose und eröffnen damit auch neue Wege für die Diagnose und Behandlung anderer Krankheiten.
Einleitung
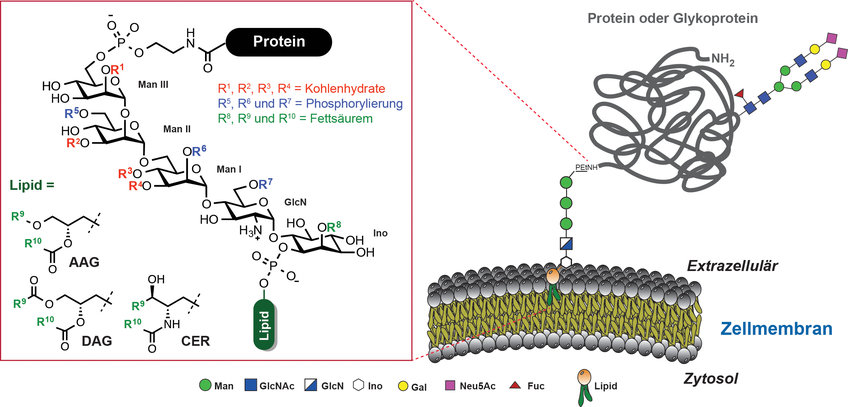
Viele Proteine sind durch Glykosylphosphatidylinositole (GPIs) in der Zelloberfläche verankert. GPIs sind komplexe und ubiquitäre eukaryotische Glykolipide mit einer konservierten Kernstruktur bestehend aus H2N(CH2)2OPO3H-Manα1→2Manα1→6Manα1→4GlcNα1→6myo-Ino1-OPO3H-Lipid [1]. Diese Kernstruktur wird zellspezifisch durch zusätzliche Kohlenhydratsubstituenten und Phosphorylierungen an verschiedenen Stellen modifiziert. Darüber hinaus weisen GPIs zahlreiche Variationen im Lipidanteil auf. Dieser besteht aus Glycerinderivaten oder Ceramiden mit Fettsäuren unterschiedlicher Länge und Sättigungsgrad (Abb. 1). Will man die Proteine in der Membran befestigen, sind die GPIs im Vergleich zu anderen Methoden sehr komplex aufgebaut und für die Zellen energieaufwendig herzustellen. Das sind Eigenschaften, die auf eine Rolle bei vielen unterschiedlichen biologischen Funktionen hinweisen.
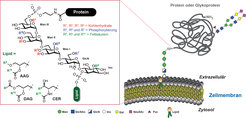
Abb. 1: GPI-Kernstruktur und mögliche Modifizierungen. AAG=Acylalkylglycerol, DAG=Diacylglycerol, CER=Ceramide, Man=Mannose, GlcN=Glucosamin, Ino=myo-Inositol, GlcNAc=N-Acetylglukosamin, Gal=Galaktose, Fuc=Fucose, Neu5Ac= Neuraminsäure.
GPIs in biologischen Systemen
GPIs und GPI-verankerte Proteine (GPI-VP) spielen eine wichtige Rolle in verschiedenen biologischen Prozessen. In höheren Eukaryoten ist die primäre Funktion von GPIs die Verankerung von Proteinen in der Zellmembran und die Lokalisierung der Proteine in speziellen Membransubdomänen, so-genannten Lipid-RAFS. Dadurch werden spezifische Interaktionen mit anderen Membranproteinen ermöglicht [2]. Die Lokalisierung der Proteine ist vor allem für Zell-Zell-Interaktionen und Signaltransduktionsprozesse essentiell [3]. Protozoen wie Trypanosoma brucei, Plasmodium falciparum oder Toxoplasma gondii nutzen freie GPIs und GPI-VP, um das Immunsystem ihres Wirtes während der Infektion zu modulieren [4]. Unter den GPI-verankerten Proteinen (GPI-VP) finden sich funktionell unterschiedliche Proteine wie Hormone, Rezeptoren, Enzyme oder Zytokine [1].
Die Rolle von speziellen GPI-Modifikationen bleibt bis jetzt unbekannt. Jedoch haben verschiedene Studien den Einfluss von GPIs auf die Faltung des verankerten Proteins demonstriert. So wurden unter anderem unterschiedliche CD-Spektren für das Thy-1 Protein mit und ohne GPI gemessen. Ferner konnte auch eine unterschiedliche Fähigkeit zur Bindung an das bakterielle Toxin Aerolysin von Aeromonas hydrophilla von Thy-1 und anderen Proteinen demonstriert werden [5], wenn diese mit und ohne GPI sind.
Im Vergleich zu Säugerzellen besitzen Protozoen über einhundertmal mehr GPI-Moleküle auf der Zelloberfläche. Zusätzlich zu den GPI-VPs in Parasiten befinden sich darunter auch sogenannte freie GPIs. Das sind nicht proteingebundene GPIs, die vermutlich die Immunantwort der Wirtszellen während des Infektionsprozesses modulieren. Studien mit isolierten und synthetischen GPI-Strukturen zeigen die Fähigkeit von freien GPIs, Makrophagen zu aktivieren oder die Bildung verschiedener pro-inflammatorischer Zytokine und Chemokine wie Tumornekrosefactor-α (TNF-α), Interleukin-1 (IL-1) oder Stickstoffmonoxid (NO) zu stimulieren [4].
Der Lipidanteil der GPIs ist vor allem für viele Interaktionen von GPIs mit Rezeptoren des Immunsystems verantwortlich. Modifizierungen der Glykankernstruktur führen bei anderen GPIs, z. B. eine spezielle α-gebundene Galaktose im GPI von T. brucei (Erreger der Schlafkrankheit), zu einem ähnlichen Effekt. Besonderes Interesse hat auch die Tatsache erregt, dass isolierte GPI-Anker eine strukturspezifische Antikörperproduktion in Mäusen induzieren können [4]. Diese Beobachtungen verdeutlichen die Notwendigkeit, definierte, homogene GPI- und GPI-verankerte Moleküle auf ihre Funktionen zu untersuchen. Die Aufreinigung von GPIs aus biologischen Quellen liefert in der Regel nur geringe Mengen heterogener Gemische von GPIs. Daher sind neue Strategien zur chemischen Herstellung dieser Glykolipide bzw. der GPI-VPs erforderlich, um die biologischen Funktionen der unterschiedlichen Strukturen gezielt untersuchen zu können.
Chemische Synthese von GPIs
Seit der Entdeckung von GPIs wurden mehrere Strategien für ihre chemische Herstellung entwickelt, von denen die meisten nur die Synthese bestimmter GPI-Strukturen erlauben. Um den Bedarf an homogenen GPIs mit möglichst vielen Modifizierungen zu decken, sind jedoch generelle Ansätze zur Herstellung dieser komplexen Glykolipide nötig. Eine dieser Strategien basiert auf der Herstellung von GPIs durch die Verwendung von austauschbaren Bausteinen (4-6) mit einem orthogonalen Schutzgruppensatz. Dies erlaubt einen effizienten Aufbau des GPI-Glykans und eine regioselektive Einführung von Phosphodiestern (Abb. 2).
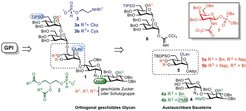
Abb. 2: Retrosynthetische Analyse einer allgemeinen Strategie für die Herstellung von GPI-Ankern. Die Glykanstruktur (schwarz-rot) wird zunächst durch die Kopplung von drei oder vier Fragmenten erhalten und die Phosphorylierungen werden im letzten Schritt selektiv eingefügt. Die orthogonalen Schutzgruppen sind in grün und blau markiert.
Die Aufbausequenz der GPIs wird durch die Position der temporären Schutzgruppen diktiert. Nach jeder Glykosylierungsreaktion findet man jede Schutzgruppe nur einmal im Produkt, um vollständige Orthogonalität zu gewährleisten. Die notwendigen Glycosylierungen für den Aufbau der GPI-Glykane werden mit ähnlichen Kopplungspartnern durchgeführt, damit die Reaktionsbedingungen für die Synthesen von verschiedenen GPIs anwendbar sind. Mithilfe dieser Strategie wurden strukturell verschiedene GPIs und GPI-Derivate für biologische und biophysikalische Untersuchungen hergestellt. Das sind unter anderem die GPIs von T. gondii, das niedermolekulare Antigen von T. gondii und der GPI-Anker des variablen Oberflächenglykoproteins (VSG) von T. congolense und von T. brucei VSG 117 [6-9].
GPI-Anker für die Diagnostik
Die hohe Menge an GPIs auf der Membranoberfläche von Protozoen macht diese Moleküle zu möglichen Markern für die Bestimmung parasitärer Infektionen durch diese Organismen. Ein Beispiel für diese Infektionen ist die Toxoplasmose durch T. gondii, das jedes warmblütige Tier infizieren kann [1]. Da der Verlauf der Infektion einer grippeartigen Erkrankung ähnelt, wird die Toxoplasmose in den Industrieländern nicht als größeres Gesundheitsproblem angesehen [4]. Dennoch kann die Infektion sich in immunkompromittierten Individuen, oder wenn die Primärinfektion während der Schwangerschaft stattfindet, zu einer gefährlichen Krankheit entwickeln. So kann es z. B. zu einer Toxoplasmose-Enzephalitis bzw. zu einer mentalen oder physischen Retardierung oder sogar zum Tod des Fötus führen.
Zwei synthetische GPIs (3 und 5) und eine Reihe von GPI-Fragmenten wurden synthetisiert. Mithilfe eines kovalenten Thiol-Linkers wurden diese dann auf die Oberfläche von epoxidbeschichteten Glasträgern gedruckt, um so das Potential von GPIs für die Diagnose von Toxoplasmose zu untersuchen. Die resultierenden GPI-Mikroarrays nutzte man anschließend für die Bestimmung von Anti-GPI-Antikörpern in Standard-Seren von Toxoplasmosepatienten in verschiedenen Erkrankungszuständen.
Die Studie zeigte, dass alle Seren von Patienten mit akuter Toxoplasmose hohe IgG- und IgM-Antikörper gegen die vollständige GPI-Struktur enthalten. Die Serumproben von latent infizierten Patienten zeigten einen IgG-Antikörperspiegel, der vergleichbar ist mit den Ergebnissen der Seren von akut infizierten Menschen. Dennoch waren die IgM-Spiegel gegen alle gedruckten Strukturen erheblich reduziert (Abb. 3). Dagegen zeigten alle Seren von nicht-infizierten Patienten keine oder niedrige IgG- und IgM-Antikörper gegen das synthetische GPI oder ihre Substrukturen [9].
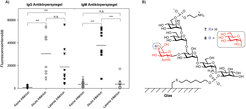
Abb. 3: A) Bestimmung der Antikörperspiegel gegen das GPI-Antigen 8 durch Mikroarrayanalyse von Serumproben, inklusive der Standardabweichung für jeden Datenpunkt für verschiedene Toxoplasmose-Kohorten. B) Struktur der GPI-Antigene.
Diese Daten stehen im Einklang mit publizierten Studien, in denen eine Immunantwort hauptsächlich gegen das freie GPI 8 und nicht gegen die GPI-Struktur 7 (ohne die α-Glucose in der Seitenkette) in T. gondii Infektionen nachgewiesen wurde. Basierend auf diesem Ergebnis stellt das synthetische freie GPI von T. gondii einen geeigneten Biomarker für die Diagnose und die Differenzierung von verschiedenen Phasen der Toxoplasmose dar. Weitere Studien mit den GPIs 7 und 8 sowie synthetischen GPIs aus anderen Parasiten werden angewandt, um weitere Eigenschaften und Anwendungen dieser Glykolipide zu untersuchen.
Biophysikalische Studien mit GPI-Fragmenten
Einblicke in das Verhalten von GPIs und GPI-verankerten Proteinen in Zellmembranen könnten zur Aufklärung der Rolle von GPIs in membranassoziierten Prozessen beitragen. In diesem Zusammenhang wurde zuerst eine vergleichende Analyse der strukturellen Anordnung in einer Serie von 2D-Modellmembranen (Monoschichten an der Luft/Wasser-Mehrfläche) aus drei GPI-Fragmenten durchgeführt. Damit soll die Beteiligung von definierten GPIs in der Bildung von Mikrodomänen in der Zellmembran untersucht werden. Eine Vergrößerung der Kopfgruppen der GPI-Fragmente von 9 zu 10 und zu 11 führt zu einer Erhöhung der Oberfläche pro Molekül, das für eine stärkere Neigung der Alkylketten und eine Erhöhung im erforderlichen Oberflächendruck für eine Phasenumwandlung verantwortlich ist (Abb. 4).

Abb. 4: A) Strukturen der untersuchten GPI-Fragmente. B) Strukturelle Veränderungen der Monoschichten von drei GPI-Fragmenten (Änderung des Neigungswinkels der Alkylketten vs. des seitlichen Oberflächendrucks π) in Phosphatpuffer bei 20 °C.
Die Verbindungen 9 und 10 bilden geordnete Monoschichten, die durch ein Kettengitter für die Alkylreste definiert sind. Demgegenüber bildet GPI-Fragment 11 hoch geordnete Monoschichten, die durch zwei kommensurable Gitter charakterisiert sind: Das sind ein Gitter der Alkylketten und ein Molekulargitter infolge der Anordnung der Kopfgruppen durch Wechselwirkungen zwischen den Glykanen. Diese polaren Wechselwirkungen sind wahrscheinlich verantwortlich für die partielle Phasentrennung von GPI-Fragment 11 in gemischten Modellmembranen mit einem flüssig-ungeordneten Phospholipid (POPC). Ist die Verbindung 11 Teil einer Mischung mit anderen Lipiden, die geordnete Phasen auf der Monoschicht bilden wie z. B. 9 oder 10, induzieren die hydrophoben Wechselwirkungen der Ketten eine vollständige Vermischung der zwei Komponenten. Die Wechselwirkungen der Kopfgruppe für eine Phasentrennung von Verbindung 11 werden dabei überwunden. Die gemischten Monoschichten von 9 oder 10 mit 11 ähneln Strukturen, die durch geordnete Alkylketten festgelegt sind. Diese Strukturen können durch typische Verpackungsparameter von Molekülen ohne Wechselwirkungen der Kopfgruppen charakterisiert werden. Weitere Experimente laufen, um festzustellen, ob das Verhalten von 11 in biologischen Membranen zu finden und auf vollständige GPI-Strukturen übertragbar ist [10].
Literaturhinweise
Annual Review of Biochemistry 57, 285-320 (1988)
Biochemical and Biophysical Research Communications 293, 714-721 (2002)
Trends in Glycoscience and Glycotechnology 24, 231-243 (2012)
Chemical Science 4, 468-481 (2013)
Physical Chemistry Chemical Physics 16, 9259-9265 (2014)
Langmuir 30, 5185-5192 (2014)
Angewandte Chemie International Edition 53, 13701-13705 (2014)
Angewandte Chemie International Edition 51, 12874-12878 (2012)