Synthetische Polypeptide und Peptoide als bioinspirierte, responsive Funktionsmaterialien
Forschungsbericht (importiert) 2013 - Max-Planck-Institut für Kolloid- und Grenzflächenforschung
Bioinspirierte Poly(aminosäuren) mit responsiven/schaltbaren Eigenschaften und der Fähigkeit, biologische Systeme (Proteine) erkennen und selektiv binden zu können, sind mit optimierten Methoden der synthetischen Polymerchemie verhältnismäßig einfach und in größeren Mengen zugänglich. Partiell glukosylierte Polyglutamate und Poly(N-alkylglycine) sind potentielle „intelligente“ Polymere für Anwendungen im biomedizinischen Bereich, etwa in der therapeutischen oder regenerativen Medizin oder der Diagnostik, und eignen sich zur Herstellung von hierarchischen Strukturen.
Einführung
Die Natur bietet eine Vielfalt an hochentwickelten und raffinierten Systemen, Materialien und Konzepten/Mechanismen, welche für technische Applikationen von großem Interesse sind, aber meist aus Gründen der Machbar- und/oder Wirtschaftlichkeit nicht direkt umsetzbar sind. Technisch besser anwendbar sind sogenannte bioinspirierte Materialien, welche Strukturen oder Funktionsweisen von biologischen Systemen oder lebenden Organismen zum Vorbild haben, ohne deren Komplexität zu erreichen. Beispiele für eine erfolgreiche Umsetzung dieses Konzepts sind die allgegenwärtigen Klettverschlüsse oder schmutzabweisenden Anstriche mit Lotus-Effekt®, ebenso wie spezielle biomedizinische Trägersysteme für eine „intelligente“ Medikamentenverabreichung.
Für Anwendungen im biomedizinischen Bereich bieten sich naturverwandte Polymere auf der Basis von Aminosäuren an, welche mit responsiven/schaltbaren oder „intelligenten“ Eigenschaften ausgestattet sind und so beispielsweise Tumorgewebe oder Viren erkennen können. Responsive Polypeptide mit zuckerhaltigen Seitengruppen sind dabei von besonderem Interesse, da Glykoproteine als eine Komponente in biologischen Zellmembranen vorkommen und Kohlenhydrate für interzelluläre Erkennungsprozesse wichtig bzw. entscheidend sind. Ziel ist aber nicht die Rekonstruktion des komplexen biologischen Systems, hier der Zellmembran, sondern die vereinfachte oder abstrakte Übertragung in ein synthetisches, biokompatibles Polymersystem.
Synthetische Polymerchemie
Polypeptide und Poly(N-alkylierte Glycine), sogenannte Polypeptoide, sind durch ringöffnende (Co-) Polymerisationen von Aminosäure-N-carboxyanhydriden (Leuchs’sche Anhydride) in größerem Maßstab zugänglich [1-5]. Die Anhydride von Aminosäuren mit ungesättigten Seitengruppen können dabei direkt, ohne Verwendung von weiteren Schutzgruppen, hergestellt und polymerisiert werden. Doppel- und Dreifachbindungen können danach weiter modifiziert werden, vorzugsweise durch eine photochemische Addition von Thiolen, beispielsweise mit Zuckern oder Fluoreszenzfarbstoffen. Die Modifizierung der Doppelbindungen verläuft meist glatt unter sehr milden oder „grünen“ Reaktionsbedingungen (Bestrahlung mit UVA- oder Sonnenlicht bei Raumtemperatur in Wasser als Lösemittel, keine Verwendung von toxischen Reagenzien oder Übergangsmetallverbindungen) [2, 4] und erfüllt alle wesentlichen Bedingungen einer Klickreaktion [6].
Mit dieser Methode können nicht nur Polymere funktionalisiert sondern auch thiol-funktionalisierte anorganische Oberflächen, beispielsweise Glasfasern und Silicapartikel, mit Polymeren beschichtet werden [7-9].
pH-responsive Glykopolypeptide
Copolypeptide bestehend aus L-Glutaminsäure- und glukosylierten Glycineinheiten nehmen in verdünnt wässriger Lösung unterschiedliche Konformationen bzw. Sekundärstrukturen ein, je nach pH-Wert der Lösung, entweder die einer α-Helix (sauer) oder eines statistischen Knäuels (neutral-basisch) [4]. Die glukosylierten Copolypeptidhelices weisen eine höhere Helizität und Stabilität im Vergleich zu Poly(L-glutaminsäure) auf und sind in Lösung außergewöhnlich stabil bis pH 3,5 sowie in 0,9 m Kochsalzlösung (0,15 m NaCl entspricht einer physiologischen Kochsalzlösung). Des Weiteren binden die glukosylierten Copolypetide selektiv an das Modellprotein Concanavalin A (Lektin aus der Jack- oder Riesenbohne) (Abb. 1). Dieses System wäre somit als „intelligentes“ Trägersystem für biomedizinische Anwendungen geeignet.
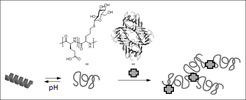
Abb. 1: pH-induziertes Schalten der Sekundärstruktur von glukosylierten Copolypeptiden und selektive Wechselwirkung mit Modellprotein (Lektin).
Temperatur-responsive Polypeptoide
Polypeptoide aus N-C3-alkylierten Glycineinheiten (C3 = propyl, allyl, isopropyl) sind in Wasser löslich und zeigen thermoresponsives Lösungsverhalten (LCST) [3]. Bei erhöhter Temperatur werden die Polymere unlöslich und fallen aus. Dieser Übergang erfolgt in bestimmten Temperaturbereichen von 15-25 °C (C3 = propyl), 27-54 °C (allyl) und 47-58 °C (isopropyl), also bei Temperaturen nahe der menschlichen Körpertemperatur. Entsprechend sind diese Systeme interessant für biomedizinische Anwendungen.
Ähnlich wie bei Poly(2-oxazolin) [10] setzt bei längerem Erhitzen der phasenseparierten (trüben) Lösung eine Kristallisation der Polypeptoide (C3 = propyl, allyl) ein. Daraus entstehen spontan Mikropartikel mit komplexer Morphologie und Schmelzpunkten von 160-200 °C (Abb. 2). Dieser Kristallisationsprozess kann genutzt werden, um Aggregate bzw. Trägersysteme für Medikamente in verdünnter Lösung zu stabilisieren.

Abb. 2: Temperatur-induziertes Schalten und Kristallisation von Poly(N-propylglycin) in wässriger Lösung.
Zusammenfassung und Ausblick
Responsive/schaltbare Polypeptide und -peptoide sind mit optimierten Methoden der synthetischen Polymerchemie gut zugänglich gemacht worden. Es steht eine Plattform von Polymeren zur Verfügung, die als Modellverbindungen, beispielsweise für Glykoproteine, oder zum Aufbau von bioinspirierten komplexeren Systemen, etwa einer biologischen Zellmembran, geeignet sind. Hieraus ergeben sich mögliche Anwendungen im biomedizinischen Bereich, etwa in der therapeutischen oder regenerativen Medizin oder der Diagnostik.
Die Polypeptide und -peptoide können nicht nur als responsive Funktionsmaterialien sondern auch als Strukturmaterialien genutzt werden. Insbesondere wasserlösliche Polypeptidhelices sollten zum einen Hydrogele bilden können und darüber hinaus flüssigkristalline Phasen und hierarchische Strukturen. Damit könnte es gelingen, eine geordnete organische Matrix herzustellen, ähnlich dem Kollagen, in der dann eine anorganische Komponente mineralisiert und schließlich ein „künstlicher Knochen“ gebildet wird.

