Peptide an Grenzflächen
Forschungsbericht (importiert) 2007 - Max-Planck-Institut für Kolloid- und Grenzflächenforschung
Einleitung
Amphiphile Peptide spielen eine herausragende Rolle in vielen biologischen Prozessen. Hier sollen zwei sehr unterschiedliche Beispiele aus grenzflächenchemischer Sicht vorgestellt werden. Zum einen geht es um einen Vertreter von β-Faltblatt bildenden Peptiden, das Amyloid β (1-40) [1], und zum anderen um ein antimikrobielles Peptid, das NK-2 [2].
Die Fibrillenbildung von Amyloid β (1-40) ist mit Krankheitsbildern wie der Alzheimer-Erkrankung verbunden. Die Faltung in ein β-Faltblatt ist dabei der erste Schritt zur weiteren Aggregation. Für die Grenzflächenforschung sind das Adsorptionsverhalten an definierten Grenzflächen und damit verbundene mögliche Änderungen in der Sekundärstruktur dieser Peptide von besonderem Interesse [1, 3, 4]. Es geht hier letztendlich um die Aufdeckung von Möglichkeiten der gezielten Beeinflussung der Sekundärstruktur durch chemisch modifizierte Grenzflächen. Entweder soll die β-Faltblatt-Bildung verhindert oder möglicherweise sogar rückgängig gemacht werden.
Die Arbeit mit antimikrobiellen Peptiden hat einen anderen Hintergrund. Bis vor kurzem galten Infektionskrankheiten als kontrollierbar. Infolge des oft unnötigen und übertriebenen Einsatzes von Antibiotika ist jedoch in den letzten Jahren ein dramatischer Anstieg von Antibiotika-resistenten Bakterienstämmen zu verzeichnen. Verschärft tritt dieses Problem in Krankenhäusern auf. Es ist daher dringend notwendig, Antibiotika zu entwickeln, die auf neuen Wirkungsmechanismen beruhen.
Auf der Suche nach Alternativen zur konventionellen antibiotischen Therapie konzentriert sich die Forschung zunehmend auf antimikrobielle Peptide (AMP). AMP sind in der Natur weit verbreitet und spielen auch bei Säugetieren als Teil des angeborenen Immunsystems neben anderen nicht-adaptiven Abwehrmechanismen eine wichtige Rolle beim Immunschutz. Die Wirkungsmechanismen der meisten AMP sind zurzeit nur unzureichend aufgeklärt. In einigen Fällen gibt es Hinweise dafür, dass sie sich aufgrund ihrer chemischen Eigenschaften (amphipathisch und kationisch) an Membranstrukturen von infektiösen Erregern anlagern und diese letztlich zerstören [5]. Da es dabei zu keiner Bindung an spezifische Rezeptoren kommt, ist die Bildung resistenter Keime unwahrscheinlich. Außerdem sind die neuen AMP gegen ein breites Spektrum von Bakterien aktiv.
Da viele biologische Prozesse an Grenzflächen verlaufen, ist die Charakterisierung der molekularen Mechanismen der Wechselwirkung von Peptiden mit Zellmembranen von grundlegender Bedeutung für ein fundiertes Verständnis der Struktur-Funktionsbeziehungen. Für biophysikalische Untersuchungen bieten sich verschiedene Modellsysteme an, die Vor- aber auch Nachteile haben, sodass ihre Kombination entscheidend für den weiteren Kenntnisgewinn ist. Diese Systeme können in 2-dimensionale Monoschichten an einer meist fluiden Grenzfläche und 3-dimensionale planare oder gekrümmte Lipiddoppel- oder multischichten eingeteilt werden. Die Wechselwirkung der Peptide mit diesen Modellsystemen wird mittels moderner biophysikalischer Methoden (z. B. Infrarotspektroskopie und Röntgenmethoden) untersucht (Abb. 1).
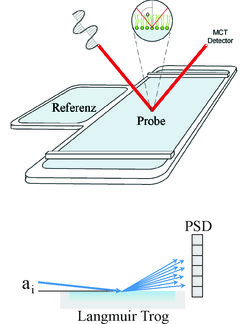
Grenzflächenaktivität von Peptiden
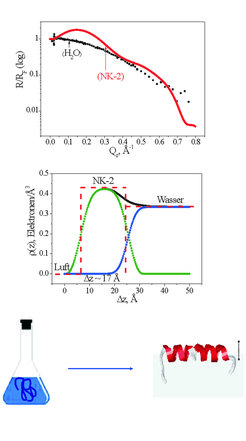
Amphiphile Peptide haben eine charakteristische Grenzflächenaktivität, die mittels Oberflächenspannungsmessungen bestimmt werden kann. In Abhängigkeit von der Volumenkonzentration der Peptide wird eine mit steigender Konzentration zunehmende Verringerung der Oberflächenspannung gemessen. Oberhalb einer für das jeweilige Peptid charakteristischen Konzentration (kritische Aggregationskonzentration) verändert sich die Oberflächenspannung nicht weiter. Sowohl für das Amyloid β (1-40) als auch das AMP NK-2 wird bei einer 1-mikromolaren Peptidlösung ein Oberflächendruck (Oberflächenspannung der reinen Pufferlösung minus Oberflächenspannung der Peptidlösung) von etwa 20 mN•m-1 gemessen. Zirkulardichroismus-Messungen zeigen, dass die Peptide in Lösung in einer ungeordneten Struktur vorliegen. Die Adsorption an die Flüssigkeit/Luft-Grenzfläche führt zu einer Veränderung der Sekundärstruktur. Die Bestimmung der Sekundärstruktur von Peptiden an einer Flüssigkeit/Luft-Grenzfläche kann mittels Infrarot-Reflexions-Absorptions-Spektroskopie (IRRAS) erfolgen [1]. Mithilfe dieser Methode können auch simultan Informationen über die Konformation und Orientierung von Lipiden an der Grenzfläche erhalten werden. Entscheidend für die Möglichkeit, Infrarotspektroskopie an einer Flüssigkeit/Luft-Grenzfläche durchführen zu können, ist ein spezieller Aufbau, der ein fast gleichzeitiges Vermessen von Referenz- und Probenspektrum durch den Einsatz einer Verschiebeeinheit ermöglicht (Abb. 1). Durch die zusätzliche Variation von Einfallswinkel und Polarisationsgrad sind auch Informationen über die Peptidorientierung an der Grenzfläche zugänglich. Dazu werden experimentelle und simulierte Spektren verglichen (Abb. 2). Das Amyloid β (1-40) bildet an der Oberfläche ein β-Faltblatt, das flach auf der Flüssigkeitsoberfläche liegt. Ob die Umwandlung von der ungeordneten (random coil) Sekundärstruktur zu einem β-Faltblatt ein einstufiger Prozess ist oder über Zwischenzustände verläuft, lässt sich experimentell leider nicht bestimmen, da der IRRAS-Technik Grenzen bezüglich der detektierbaren Peptidkonzentration an der Oberfläche gesetzt sind. Hierfür können nun Molekular-Dynamik-Simulationen hilfreich sein. Das sich bildende β-Faltblatt ist gut geordnet. Röntgenbeugung unter streifendem Einfall (Abb. 1) unter Nutzung von Synchrotronstrahlung liefert einen deutlichen Bragg-Reflex, der den typischen Wiederholabstand von 0,475 nm anzeigt.

Im Fall des NK-2 führt die Adsorption an die Flüssigkeit/Luft-Grenzfläche zu einer Umwandlung in eine α-Helix, die, wie Vergleiche mit simulierten IRRA-Spektren zeigen, mit der Längsachse parallel zur Flüssigkeitsoberfläche ausgerichtet ist. Mittels Röntgenreflexionsexperimenten konnte die Dicke dieser Peptidschicht bestimmt werden (Abb. 3). Mit 1,7 nm liegt sie im für eine Helix erwarteten Größenbereich.
Wechselwirkung von Peptiden mit Phospholipiden
Phospholipidmonoschichten an einer Flüssigkeit/Luft-Grenzfläche sind geeignete Modellsysteme, um Vorgänge an Membranoberflächen mit biophysikalischen Methoden zu untersuchen. Die Lipiddichte und gegebenenfalls der Phasenzustand können durch eine einfache mechanische Verringerung der molekularen Fläche gezielt verändert werden. Lipidmonoschichten haben eine große Strukturvielfalt, die sowohl von der Kopfgruppenstruktur als auch dem Kettenbereich bestimmt wird [7]. Die Bedeutung der Lipidmatrix für die Wechselwirkung mit den untersuchten Peptiden und mögliche Strukturveränderungen standen im Mittelpunkt dieser Untersuchungen. Ein für die Wirkungsweise der AMP wichtiger Unterschied der äußeren Oberfläche von Bakterien- und von normalen Säugerzellen scheint die Ladung zu sein. Sowohl Gram-negative als auch Gram-positive Bakterien weisen eine negativ geladene Oberfläche auf. Im Vergleich dazu ist die Außenseite eines Erythrozyten als Repräsentant einer Säugerzelle neutral, da hier hauptsächlich zwitterionische Phospholipide zu finden sind. Damit scheint die Bindung der positiv geladenen AMP an die Außenseite der negativ geladenen Bakterienmembran durch elektrostatische Wechselwirkungen erleichtert zu sein.
Werden nun zwitterionische Phospholipidmonoschichten bei großen molekularen Flächen vorgelegt, so führt die Peptidadsorption zu Oberflächendruckwerten, wie sie schon an der reinen Flüssigkeit/Luft-Grenzfläche beobachtet wurden. Die adsorbierten Peptide belegen den freien Raum in der Oberfläche und komprimieren die sich dort befindlichen Phospholipide. Der Adsorptionsprozess kann damit zu induzierten Phasenumwandlungen in der Phospholipidschicht führen, die bereits mit optischen Methoden wie der Fluoreszenzmikroskopie zu beobachten sind. IRRAS-Experimente zeigen nun, dass die Sekundärstruktur der Peptide in der Adsorptionsschicht die gleiche ist wie an der reinen Flüssigkeit/Luft-Grenzfläche. NK-2 wandelt sich also von einer ungeordneten Struktur im Volumen in eine α–helikale Struktur an der Membran um. Wird eine solche komplexe Schicht über den Gleichgewichtsdruckwert hinaus komprimiert, so wird das Peptid langsam aus der Phospholipidschicht herausgedrückt. Der Desorptionsprozess verläuft dabei deutlich langsamer als der Adsorptionsprozess. Bei dem für biologische Membranen diskutierten charakteristischen Druck von 30 mN•m-1 liegt eine rein zwitterionische Phospholipidschicht vor. Die Peptide sind vollständig desorbiert und befinden sich nicht mehr in Oberflächennähe. Dieser Befund zeigt klar, dass sowohl Amyloid β (1-40) als auch NK-2 nicht mit ungeladenen hydrophilen Grenzflächen wechselwirken.
Kommen elektrostatische Wechselwirkungen zwischen entgegengesetzt geladenen Phospholipidkopfgruppen und dem Peptid ins Spiel, dann ändert sich das Bild. Zunächst penetrieren die Peptide wiederum in eine unkomprimierte anionische Monoschicht und werden bei Druckerhöhung aus dieser auch wieder herausgedrückt. Der Desorptionsprozess wird zusätzlich vom Phasenzustand der Lipidschicht beeinflusst. Amyloid β (1-40) kann auch bei hohen Druckwerten in einer fluiden anionischen Monoschicht verbleiben während es aus einer gut strukturierten Schicht vollständig herausgedrückt wird. Offensichtlich überwiegen hier die Wechselwirkungen zwischen den geordneten Phospholipidketten. Das herausgedrückte Amyloid β (1-40) ist aber auf Wasser in einer β-Faltblattstruktur elektrostatisch an die anionischen Phospholipidkopfgruppen gekoppelt.

Die α-Helix des penetrierten AMP NK-2 liegt in anionischen Monoschichten nicht mehr flach auf der Flüssigkeitsoberfläche sondern ist geneigt, um bis in den hydrophoben Kettenbereich der Phospholipide hineinzureichen. Kompression führt auch hier zum Herausdrücken des Peptids. Bei Druckwerten über 30 mN•m-1 ist auch NK-2 weiterhin an die geladene hydrophile Grenzfläche adsorbiert (Abb. 4). Dieser Befund zeigt, dass die Wechselwirkung des AMP NK-2 wesentlich durch die Ladung an der Membranoberfläche gesteuert wird. Negativ geladene Bakterienmembranen weisen damit eine deutlich stärkere Wechselwirkung mit dem AMP auf als zwitterionische Membranen. Diese Befunde werden auch durch Zirkulardichroismus-Messungen gestützt, die zeigen, dass die Titration einer NK-2 Lösung mit zwitterionischen Phospholipidvesikeln keine Änderung in der Sekundärstruktur des Peptids bewirkt, während die Titration mit anionischen Vesikeln zu einer Umwandlung von ungeordnet zu α-helikal führt. Interessanterweise wird auch die anionische Monoschicht durch das AMP NK-2 beeinflusst. Der laterale Druck, der aufgebracht werden muss, um die Phospholipidschicht von einem flüssigkeitsähnlichen in einen geordneten flüssig-kristallinen Zustand zu überführen, wird durch das Peptid deutlich erhöht. NK-2 reduziert die laterale Ordnung im Lipidfilm.
Die hier vorgestellten Experimente zeigen, dass einfache Modellsysteme in Kombination mit ausgefeilten oberflächenempfindlichen Messtechniken interessante neue Erkenntnisse auf molekularem Niveau liefern können. Diese sind geeignet, Schritte zu wichtigen Erkrankungen zu verstehen und neue therapeutische Möglichkeiten zu eröffnen.



