Kontrollierte Synthese von Anorganischen Nanomaterialien durch Organische Reaktionen
Forschungsbericht (importiert) 2005 - Max-Planck-Institut für Kolloid- und Grenzflächenforschung
Einleitung
Seit vielen Jahrzehnten beschäftigt sich die Chemie mit der Herstellung von Partikeln verschiedenster Formen, Größen und Zusammensetzungen. Insbesondere Materialien mit hoher Einheitlichkeit weckten die Neugier der Wissenschaftler. Später zeigte sich die Bedeutung von homogenen Pulvern auch in vielen Bereichen moderner Technologie. Unter Berücksichtigung der Tatsache, dass etwa 80 Prozent der Produkte der chemischen Industrie heute in Form von Partikeln vorliegen oder sich in ihrer Herstellung auf Partikeltechnologie stützen, ist es offensichtlich, dass die Pulversynthese weiterhin eine führende Rolle in der wissenschaftlichen wie auch industriellen Forschung einnimmt. Durch die rasant voranschreitende Miniaturisierung und dem damit verbundenen Übergang von der Mikro- zur Nanotechnologie werden gleichzeitig auch immer kleinere Partikel benötigt, wodurch der Begriff „Nano“ auch in der Chemie fast allgegenwärtig wird.
Obwohl es keine klare Definition gibt, werden Teilchen typischerweise als Nanopartikel bezeichnet, deren Größe zwischen 1 und 100 nm liegt. Es zeigte sich bald, dass Partikel im Größenbereich von einigen Nanometern physikalische und chemische Eigenschaften haben, die sich signifikant vom grobkörnigen Festkörper der gleichen Zusammensetzung unterscheiden können. Die Erklärung für diese Beobachtung liegt einerseits darin, dass die Oberfläche im Verhältnis zum Volumen immer größer wird, je kleiner die Partikel werden (2 nm große Partikel haben 80 Prozent ihrer Atome an der Oberfläche!), und andererseits führt die Einschränkung der Beweglichkeit der Elektronen aufgrund der kleinen Dimensionen zum so genannten „Quantum Size Effect“ [1].
Bei der Entwicklung neuer Materialien nutzt man diese Effekte aus, indem die Eigenschaften eines Stoffes durch Variation der Größe und eventuell auch der Form der nanoskaligen Bausteine kontrolliert werden – ohne notwendigerweise die Zusammensetzung ändern zu müssen. Damit bekam der Chemiker ein zusätzliches Werkzeug in die Hand, das ihm sehr weitreichende Möglichkeiten bei der Materialsynthese eröffnete. Die Schwierigkeit und gleichzeitig das Ziel liegen nun einerseits darin, Form und Größe von Nanopartikeln gezielt zu steuern, und andererseits die kontrollierte Anordnung dieser Nanopartikel zu größeren, hierarchisch geordneten Strukturen mit möglichst neuen Eigenschaften und Funktionen zu ermöglichen [2]. Um jedoch solche Systeme, die typischerweise 50.000-mal kleiner als der Durchmesser eines menschlichen Haares sind, handhaben zu können, sind innovative Synthesemethoden und aufwendige Charakterisierungstechniken gefragt.
Nichtwässrige Synthese von Metalloxid-Nanopartikeln
Bei den anorganischen Funktionsmaterialien spielen Metalloxide eine herausragende Rolle. Sie besitzen eine besonders große Bandbreite an Eigenschaften und Anwendungsmöglichkeiten. Metalloxide können auf unterschiedlichste Art und Weise hergestellt werden. Konventionelle Festkörperverfahren, die auf der Reaktion von pulverförmigen Ausgangsmaterialien basieren, ergeben dabei Produkte, bei denen die Partikelgröße wie auch die Homogenität der Probe nur geringen Anforderungen entspricht. Im Gegensatz dazu erlauben nasschemische Methoden, insbesondere wässrige Sol-Gel-Prozesse, gute chemische Kontrolle vom molekularen Ausgangsmaterial bis zum finalen Endprodukt und führen zu homogenen Produkten bei niedrigen Reaktionstemperaturen. Die wässrige Sol-Gel-Chemie wird häufig angewendet, birgt aber Nachteile für die Synthese von nanokristallinen Metalloxiden. In den meisten Fällen sind die direkt erhaltenen Produkte amorph, und die Überführung in kristalline Materialien durch thermische Behandlung führt zu schwer kontrollierbarem Kristallwachstum.
Mit der Entwicklung der nichtwässrigen Sol-Gel-Chemie kam eine wertvolle Alternative ins Spiel, die viele dieser Probleme lösen oder umgehen kann. Während in wässrigen Prozessen die Metalloxidvorstufen durch Zugabe von Wasser mittels Hydrolyse und Kondensation ins entsprechende Metalloxid überführt werden, kommen nichtwässrige Prozesse, wie der Name schon sagt, ohne zusätzlichen Wassereintrag aus. Der Trick liegt darin, dass die organischen Komponenten in der Reaktionslösung das Wasser mittels chemischer Reaktionen „vor Ort“ produzieren und so ganz neue Reaktionsabläufe stattfinden. Die sauerstoffhaltigen organischen Komponenten übertragen die Sauerstoffatome direkt auf das Metall und bauen so das Metalloxid auf. Das Wachstum der anorganischen Partikel wird jetzt über organische Reaktionsprozesse, die in vielen Fällen besser kontrollierbar sind, gesteuert.
Um die Vielfältigkeit nichtwässriger Systeme zu zeigen, wird nachfolgend die Reaktion von Benzylalkohol mit verschiedenen Metalloxidvorläufern wie Metallchloriden und Metallalkoxiden als Beispiel diskutiert. Benzylalkohol ist einerseits ungiftig und hat andererseits einen besonders positiven Einfluss auf die Nanopartikelbildung, z.B. in Bezug auf Kristallinität und Größenstabilisierung. Es zeigte sich, dass in einem einfachen „Eintopf-Verfahren“ ein erstaunlicher Grad an Kontrolle über die entstehenden Nanopartikel gewonnen werden kann und gleichzeitig eine große Vielfalt an manchmal überraschenden Partikelmorphologien erhalten wird.
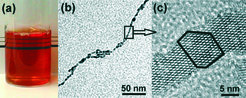
Die Reaktion von Titantetrachlorid mit Benzylalkohol führt bei Temperaturen unter 100 °C zu hochkristallinen Nanopartikeln in der Anatas-Modifikation. Da das Verhältnis von TiCl4 zu Benzylalkohol wie auch die Reaktionstemperatur die Partikelgröße beeinflussen, kann durch gezielte Variation dieser Syntheseparameter die Kristallitgröße zwischen 4 und 8 nm schrittweise eingestellt werden. Die außergewöhnlich tiefe Reaktionstemperatur erlaubt es, organische Moleküle zum Reaktionsgemisch zu geben, die dann an die Oberfläche der Nanopartikel binden und damit die Dispergierbarkeit wie auch das Agglomerationsverhalten der Endprodukte bestimmen. Dopamin-funktionalisiertes Titanoxid zum Beispiel ist in Wasser dispergierbar [3]. Die Teilchen sind so klein und elektronisch modifiziert, dass transparente, rot gefärbte Lösungen entstehen (Abb. 1a). Dagegen ordnen sich Partikel mit oberflächengebundenem Trizma zu kettenartigen Nanostrukturen an (Abb. 1b) [4]. Interessanterweise findet diese Agglomeration hoch kontrolliert statt, sodass sich nur bestimmte kristallographische Flächen berühren können, wobei anisotrope, praktisch einkristalline Strukturen entstehen (Abb. 1c). Trotzdem kann man die einzelnen Partikel aufgrund der texturierten Oberfläche noch erkennen (siehe Umriss in Abb. 1c). Dieser Prozess erlaubt damit, das Aggregationsverhalten von Nanopartikeln so zu programmieren, dass sie nach dem Dispergieren in einem Lösungsmittel ohne Zuhilfenahme weiterer Stoffe oder Schritte in geordnete Nanostrukturen übergehen – ein erster wichtiger Schritt auf dem Weg zum Aufbau komplexer Strukturen ausgehend von partikulären Bausteinen.
Neben Titanchlorid reagiert auch Wolframchlorid mit Benzylalkohol. In diesem Fall entstehen aber keine kugelförmigen Nanopartikel, sondern kleine Wolframoxid-Plättchen (Abb. 2a). Durch Zugabe einer geringen Menge von Deferoxamin, einem Molekül, das zur Familie der Siderophore gehört, kann die Partikelmorphologie komplett verändert werden. Anstelle von Plättchen entstehen faserartige Strukturen (Abb. 2b), die wiederum aus gebündelten, kristallinen, und dennoch hochflexiblen Nanodrähten mit einem einheitlichen Durchmesser von ca. 1,3 nm bestehen (Abb. 2c) [5]. Diese Beispiele zeigen, dass durch die Zugabe von organischen Liganden sowohl Morphologie, Dispergiereigenschaften wie auch Agglomerationsverhalten von Nanopartikeln kontrolliert werden können.

Die Umsetzung von Metallalkoxiden mit Benzylalkohol ermöglicht einen halogenidfreien Zugang zu Metalloxid-Nanopartikeln. Dieser simple Ansatz erlaubt die Herstellung vieler verschiedener Oxide, von einfachen binären Materialien wie HfO2, SnO2, In2O3, ZrO2, CeO2 [6, 7] bis zu komplexeren Perowskiten wie BaTiO3 [8]. Transmissionselektronenmikroskopische (TEM) Aufnahmen in Abbildung 3 zeigen, dass im Falle von HfO2 ellipsoidale, 2-3 nm große Partikel gebildet werden (Abb. 3a). Die Vergrößerung eines einzelnen Partikels zeigt regelmäßig angeordnete Linien, die den Gitterebenen im Kristall entsprechen und damit einen deutlichen Beweis für die hohe Kristallinität darstellen. BaTiO3 formt eher runde Partikel mit einer Größe von etwa 5-8 nm (Abb. 3b). Auch in diesem Fall zeigt eine hochauflösende Aufnahme die ausgeprägte Kristallinität. BaTiO3 wird industriell im Tonnen-Maßstab für die Herstellung von elektrokeramischen Bauteilen eingesetzt. Um die Miniaturisierung dieser Bauteile aber weiter voranzutreiben, ist die Verfügbarkeit von BaTiO3 als Nanopartikel ein Schlüsselschritt.

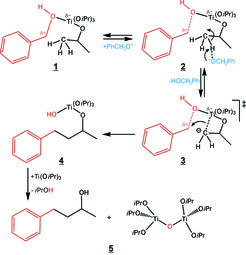
Am Beispiel von Bariumtitanat wird nachfolgend die Synthese etwas detaillierter aufgezeigt und auch ein möglicher Bildungsmechanismus vorgeschlagen. Bei der Synthese wird metallisches Barium in Benzylalkohol aufgelöst, Titanisopropoxid zugegeben und die Reaktionsmischung bei 200 °C umgesetzt. Aus der Zusammensetzung wird schon deutlich, dass sich das entsprechende Metalloxid nur durch „Sauerstoffraub“ aus den organischen Komponenten bilden kann. Durch Analyse der organischen Produkte in der finalen Reaktionsmischung können Indizien für den Bildungsmechanismus erhalten werden. Es zeigte sich, dass während der Nanopartikelbildung auch eine fast stöchiometrische Menge an 4-Phenyl-2-butanol entsteht (siehe Abb. 4). Diese Komponente kann sich nur durch eine C-C-Verknüpfung zwischen Benzylalkohol und dem Isopropanolat-Liganden gebildet haben, wobei gleichzeitig die OH-Gruppe des Benzylalkohols als Abgangsgruppe die Kondensation zwischen zwei Titanzentren ermöglicht (Abb. 4) [9]. Durch vollständige Kondensation aller Titanatome entsteht unter Einlagerung der Bariumionen das entsprechende Oxid.
Zusammenfassung und Ausblick
Obwohl die Synthese von anorganischen Nanomaterialien in den letzten Jahren große Fortschritte erzielt hat, fehlen ihr allgemeingültige, grundlegende Synthesekonzepte. Die Herstellung von Metalloxiden in organischen Lösungsmitteln unter Ausschluss von Wasser offeriert diesbezüglich einige Vorteile. Im Vergleich zu wässrigen Systemen ist die Prozessführung sehr einfach und generell auf viele verschiedene Oxide anwendbar. Die größte Chance liegt aber darin, dass durch das Verständnis der organischen Reaktionsabläufe, die parallel zur Nanopartikelbildung einhergehen, erste Schritte in Richtung eines rationalen Synthesedesigns für anorganische Nanopartikel gemacht werden können. Die Kontrolle über die organischen Reaktionsschritte ermöglicht gleichzeitig eine Kontrolle über die Nanopartikelbildung – womit zum ersten Mal eine voraussagbare Gesetzmäßigkeit für die Synthese von anorganischen Feststoffen in Reichweite rückt.



