Mit dem Mikro-Shuttle in lebende Zellen
Wissenschaftlern des Max-Planck-Institutes für Kolloid- und Grenzflächenforschung in Potsdam-Golm, der Jacobs University Bremen und der Queen Mary University London ist es erstmals gelungen stoffwechselresistente Mikrokapseln in lebende Zellen einzuschleusen und deren Inhalt durch Laserimpuls mit exakter zeitlicher Kontrolle freizusetzen. Mit dieser Methode dokumentierten die Forscher erstmals intrazelluläre Immunprozesse in hoher Zeitauflösung, d.h. vom Freisetzen zellfremder Proteine im Zellinneren bis zu deren Einbau als Antigene an der Zelloberfläche (Small DOI: 10.1002/smll.200900809).
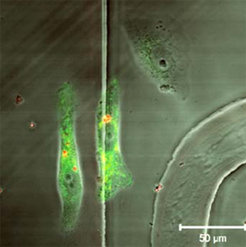
Jede Körperzelle besitzt einen Stoffwechsel, über den aufgenommene Stoffe zu zelleigenen Verbindungen umgewandelt, zur Energie-gewinnung oder zum Aufbau der Zelle genutzt werden. Stoff-wechselprozesse, wie z.B. die Immunantwort auf Virus-Infektionen, können aber nur hinreichend verstanden werden, wenn die Transport- und Umsetzungsschritte der beteiligten Substanzen zeitgenau nachvollzogen werden können. Dafür werden oft Markermoleküle verwendet, deren Schicksal man in den Zellen mit verschiedenen Nachweismethoden verfolgt. Viele dieser Methoden haben einen entscheidenden Nachteil: Die molekularen Marker können nicht in ausreichender Menge in die lebenden Zellen eingeschleust werden. Andere Präparationsmethoden mit höheren Reagenz-Konzentrationen beeinträchtigen wiederum die Zellfunktionen und somit den normalen Ablauf der untersuchten Prozesse.
Ziel der Forschungskooperation war es jetzt, lebende Zellen möglichst schonend mit definierten Mengen experimenteller Marker zu präparieren und diese dann kontrolliert zu einem definierten Zeitpunkt im Zellinneren freizusetzen. Dies sollte erst geschehen, nachdem sich die Zellen von negativen Präparationseffekten erholt haben. Für die Substanz-Einschleusung entwickelten die Forscher „Miniaturshuttles“ aus speziellen stoffwechselresistenten Kunststofffasern mit eingelagerten Nano-Goldpartikeln. Die Mikrotransporter besitzen einen Durchmesser von rund zwei Mikrometern, was der Größe eines kleinen Bakteriums entspricht. Hergestellt werden die Kapseln, indem man die Kunststofffasern netzartig um einen mineralischen Kern wickelt, der dann durch Säure herausgelöst wird. Die so entstandenen porösen Mikro-Hohlkugeln können die gelöste Testsubstanz aufsaugen und werden dann versiegelt, indem die Kunststoffmoleküle durch Erwärmen geschrumpft und die Poren so verschlossen werden.
In die lebenden Zellen gelangen die gefüllten Kapseln mittels Diffusion durch die Zellwände. Durch Elektroporation, eine Art Elektroschockbehandlung, werden sie für Partikel dieser Größe durchlässig gemacht. Um die Testsubstanz im Zellinneren freizusetzen, werden die Zellen dann mit einem Infrarotlaser beschossen, der die Zellen nicht schädigt, jedoch von den Nano-Goldpartikeln in den Kapselwänden absorbiert wird. Die „Shuttles“ erhitzen sich, die Kapselwände schmelzen auf. Zur Validierung der Methode schleusten die Wissenschaftler Mikrokapseln mit künstlichen, Fluoreszenzmarkierten Proteinfragmenten in das Innere von flüssig kultivierten, lebenden Nagetierzellen ein. Auf diese Weise wurde kontrolliert eine Immunantwort der Zellen, die sogenannte Antigenpräsentation, an der Zelloberfläche, ausgelöst. Nach der Freisetzung der Marker durch Laserimpuls konnten die Forscher die Ausbreitung der zellfremden Peptidmarker in der Zelle, ihre Aufnahme durch Protein-Komponenten des Immunsystems, den sogenannten MHCProteinen, und ihren Transport an die Zelloberfläche sowie ihren dortigen Einbau als Antigene in hoher zeitlicher Auflösung unter dem Fluoreszenzmikroskop beobachten.
Die am Max-Planck-Institut für Kolloid- und Grenzflächenforschung entwickelte Methode der Kapselherstellung zeichnet sich durch ihre hohe Vielseitigkeit aus, da sehr verschiedene Polymere und Nanopartikel verwendet und somit maßgeschneidert werden können. Die Gruppe um André Skirtach und Helmuth Möhwald konnte zudem zeigen, dass die Kapselwand nur für die Dauer des Laserpulses und nur lokal (30nm) aufgeschmolzen wird. Damit können viele Freisetzungsprofile und Substanzmengen erreicht werden, was wiederum ein großes Einsatzgebiet eröffnet, so z.B. die Umprogrammierung oder Selektion von Zellen in der Stammzellforschung. „Für die Therapie erscheint die Methode nur auf den ersten Blick ungeeignet. Bedenkt man jedoch, dass Infrarotlicht extra einen Zentimeter tief in ein Gewebe eindringen kann und das in der Medizin die Diagnose und Therapie mit Lichtleitfasern immer verfeinerter erfolgt, ist auch eine lichtinduzierte Wirkstofffreisetzung im Gewebe keine Utopie mehr“, sagt Helmuth Möhwald, Direktor der Abteilung Grenzflächen am Max-Planck-Institut für Kolloid- und Grenzflächenforschung. Für eine derartige Entwicklung ist jedoch noch eine langjährige Grundlagen- und auch angewandte Forschung nötig.












